Índice |
Características físicas
Devido a natureza elétrica das partículas acima mencionadas, um campo de força é presente em todo o espaço à sua volta. As interações entre estes campos de força de uma partícula para a próxima dão origem as forças intermoleculares. Dependentes da distância, estas forças intermoleculares influenciam o movimento dessas partículas, e conseqüentemente, suas propriedades termodinâmicas. À temperaturas e pressões características de muitas aplicações, essas partículas são normalmente muito separadas. Esta separação corresponde a uma força atrativa muito fraca. Como resultado, para muitas aplicações esta força intermolecular torna-se insignificante.Um gás também apresenta as seguintes características:
- Densidade relativamente baixa e viscosidade comparável a dos estados sólido e líquido.
- Volume muito sensível as mudanças na temperatura ou pressão, por isso o termo "compressíveis".
- Difusão rápida, espalhando-se rapidamente, de forma a distruibuir-se homogeneamente e preencher totalmente qualquer recipiente.
Pressão
Temperatura
Volume específico
Densidade
Escala microscópica
Teoria cinética
A teoria também explica como o sistema gasoso responde a mudanças. Quando um gás é aquecido, a velocidade das partículas aumenta. Isto resulta em um número maior de colisões por segundo com as paredes do recipiente devido as velocidades serem maiores com a temperatura mais elevada. E isto explica o aumento de pressão com o aumento da temperatura.
Movimento browniano
Forças intermoleculares
Modelos simplificados
Gás real
Os gases reais não se expandem infinitamente. Isto se deve a que entre suas partículas, quer sejam átomos como nos gases nobres ou moléculas como no (O2) e na maioria dos gases, se estabelecem umas forças bastante pequenas, devido aos mudanças aleatórias de suas carga eletrostáticas, a que se chama forças de Van der Waals.
O comportamento de um gás geralmente concorda mais com o comportamento ideal quanto mais simples for sua fórmula química e quanto menor for sua reatividade (tendencia a formar compostos). Assim, por exemplo, os gases nobres por serem compostos de moléculas monoatômicas e terem baixíssima reatividade, sobre tudo o hélio, têm um comportamento bastante próximo ao ideal. Os seguem os gases diatômicos, em particular o menos denso, o hidrogênio. Menos ideais são os tri-atômicos, como o dióxido de carbono; o caso do vapor de água é ainda pior, já que a molécula, por ser polar, tende a estabelecer pontes de hidrogênio, o que reduz ainda mais a idealidade. Dentre os gases orgânicos, o que tem o comportamento mais próximo do ideal é o metano perdendo idealidade a medida que se engrossa a cadeia de carbono. Assim, o butano tem um comportamento bem distante da idealidade. Isso ocorre porque quanto maiores os constituintes da partícula do gás, maior a probabilidade de colisão e interação entre eles, um fator que diminui a idealidade. Alguns desses gases podem ser razoavelmente bem aproximados pelas equações ideais, enquanto em outros casos exigirão o uso de equações obtidas empiricamente, muitas vezes a partir do ajuste de parâmetros. Também se perde idealidade em condições extremas, tais como pressão muito alta ou temperaturas muito baixas. Por outro lado, o acordo com a idealidade pode aumentar em pressões baixas ou altas temperaturas.
Gás ideal
Gás perfeito
Termicamente perfeito
Síntese histórica
Lei de Boyle
Matematicamente:
Lei de Charles
Matematicamente:
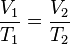 ou
ou  .
.
Lei de Gay-Lussac
Lei de Dalton
Matematicamente:
Ptotal = P1 + P2 + ... + Pn
Tópicos especiais
Compressibilidade
Número de Reynolds
Viscosidade

Visão de satélite de um padrão climático mostra um padrão de nuvens turbulentas único chamado de vórtice de von Kármán.
Turbulência

Asa delta
em um túnel de vento. As sombras se formam de acordo com as mudanças de
índices de refração dentro do gás enquanto ele é comprimido na borda da
asa.
Camada limite
Princípio da máxima entropia
Equilíbrio termodinâmico
Efeitos fisiológicos
Outra classificação possível para os gases é aquela que considera os efeitos para a saúde humana, quando inalados. Assim, há os inofensivos (oxigênio, hélio), quando dispersos em quantidade normal na atmosfera, e os venenosos (capazes de matar). Dentre os últimos podemos citar:- Tóxicos: ácido cianídrico (produz a morte quase instantaneamente), amoníaco do anidro sulfuroso, benzina, iodacetona, cianuretos alcalinos de potássio, sódio etc.
- Asfixiantes: que provocam a cessação das trocas orgânicas (provocando a redução do teor de oxigênio e o consequente aumento de gás carbônico no sangue) tais como oxicloreto, tetraclorossulfureto de carbono, cloroformiato de metila clorado, bromo, fosgeno.
Referências
- ↑ J. Clerk Maxwell. Theory of Heat. Mineola: Dover Publications, 1904. 319–20 p. ISBN 0486417352
- ↑ See pages 137–8 of Society, Cornell (1907).
- ↑ For assumptions of Kinetic Theory see McPherson, pp.60–61
- ↑ http://e-fisica.fc.up.pt/edicoes/2a-edicao/projectos/movimento-browniano/apresentacao
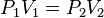

Nenhum comentário:
Postar um comentário